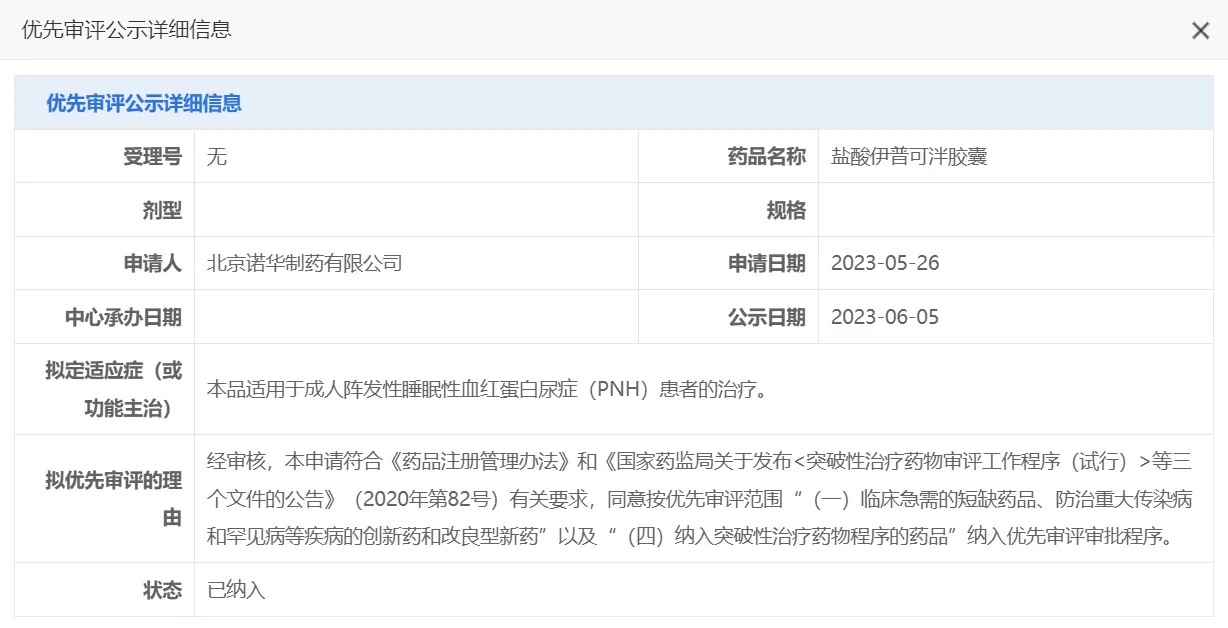
诺华今日宣布,国家药品监督管理局药品审评中心(CDE)正式受理诺华创新药iptacopan(LNP023)胶囊的上市许可申请并将其纳入优先审评程序,其拟定适应症为用于成人阵发性睡眠性血红蛋白尿症(PNH)患者的治疗。这一突破性的药物将为PNH患者带来全新治疗选择,助力其重获健康和希望。
PNH现有治疗手段有限
PNH是一种由于体细胞Xp22.1上PIG-A基因突变导致的获得性造血干细胞克隆性疾病。其发病机制包括造血干细胞PIG-A基因突变,使部分或完全血细胞膜糖化磷脂酰肌醇(GPI)锚合成障碍,造成血细胞表面GPI锚连蛋白缺失,细胞灭活补体等能力减弱,从而引起细胞容易被破坏1。血管内溶血、潜在的造血功能衰竭和血栓形成倾向是其3个主要临床表现2。根据我国牡丹江地区的长期调研数据,PNH发病率为2.85例/每100万人口3。
PNH于2018年被纳入我国《第一批罕见病目录》,传统治疗包括糖皮质激素治疗、对症支持治疗、免疫抑制剂治疗等,但这些疗法不能真正控制溶血,且长期频繁治疗可能给患者带来感染、肺动脉高压、肾功能损伤等诸多难题。此外,异基因造血干细胞移植一般限于难治性PNH患者,而配型困难、移植物抗宿主病等因素严重限制了其临床应用。
补体抑制剂开创了PNH靶向治疗的新时代,已上市的C5补体抑制剂由于持续性C3介导的血管外溶血4,部分患者仍无法摆脱输血依赖,同时,静脉注射和皮下注射给药也影响了患者的生活质量。
补体B因子抑制剂为PNH靶向治疗带来突破
此次纳入优先审评程序的iptacopan是一款首创、口服、高效、选择性、小分子、可逆性补体因子B(FB)抑制剂5。iptacopan治疗PNH的关键性III期研究APPLY-PNH研究6和APPOINT-PNH7研究均已达到了主要终点,证实其可抑制血管内溶血和血管外溶血,口服给药方式也可以提高患者的依从性,改善患者的用药体验,为PNH治疗领域带来了突破。
2023年3月, iptacopan获得CDE突破性治疗药物的认定,用于PNH患者的治疗。这是其继2022年3月获得C3肾小球病(C3G)适应症的突破性药物认定后,再次在中国获得突破性治疗药物的认定。此前,iptacopan获FDA突破性疗法的认定,用于治疗PNH;获FDA及EMA孤儿药的认定,用于治疗PNH及C3G;获EMA PRIME(优先药物计划)的认定,用于治疗C3G。
声明
iptacopan尚未在中国大陆获批。所有信息仅为新闻发布目的提供。